大学有机化学实验
试验一 蒸馏
一、试验目的
1、 熟悉蒸馏法分离混合物方法
2、 掌握测定化合物沸点的方法
一、 试验原理
1、 微量法测定物质沸点原理。
2、 蒸馏原理。
二、试验仪器及药品
圆底烧瓶、温度计、蒸馏头、冷凝器、尾接管、锥形瓶、电炉、加热套、量筒、烧杯、毛细管、橡皮圈、铁架台、沸石、工业酒精
三、试验步骤
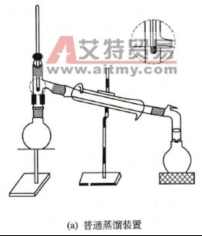
(1)加料 取一干燥圆底烧瓶加入约50ml的工业酒精,并提前加入几颗沸石。
(2)加热 加热前,先向冷却管中缓缓通入冷水,在打开电热套进行加热,慢慢增大火力使之沸腾,再调节火力,使温度恒定,收集馏分,量出乙醇的体积。
蒸馏装置图
四、试验数据处理
五、思考题
1、蒸馏时,放入沸石为什么能防止暴沸?若加热后才发觉未加沸石,应怎样处理?
2、向冷凝管通水是由下而上,反过来效果会怎样?把橡皮管套进冷凝管侧管时,怎样才能防止折断其侧管?
六、装置问题:
(1)选择合适容量的仪器:液体量应与仪器配套,瓶内液体的体积量应不少于瓶体积的1/3,不多于2/3。
(2)温度计的位置:温度计水银球上线应与蒸馏头侧管下线对齐。
(3)接受器:接收器两个,一个接收低馏分,另一个接收产品的馏分。可用锥形瓶或圆底烧瓶。蒸馏易燃液体时(如乙醚),应在接引管的支管处接一根橡皮管将尾气导至水槽或室外。
(4)安装仪器步骤:一般是从下→上、从左(头)→右(尾),先难后易逐个的装配,蒸馏
(5)装置严禁安装成封闭体系;拆仪器时则相反,从尾→头,从上→下。
(6)蒸馏可将沸点不同的液体分开,但各组分沸点至少相差30℃以上。液体的沸点高于140℃用空气冷凝管。
(7)进行简单蒸馏时,安装好装置以后,应先通冷凝水,再进行加热。
试验二 重结晶及过滤
一、试验目的
1、学习重结晶提纯固态有机物的原理和方法
2、学习抽滤和热过滤的操作
二、试验原理
利用混合物中各组分在某种溶液中的溶解度不同,或在同一溶液中不同温度时溶解度不同而使它们分离
三、试验仪器和药品
循环水真空泵、抽滤瓶、布氏漏斗、烧杯、电炉、石棉网、玻璃棒、滤纸、苯甲酸、活性炭、天平
四、试验步骤
1、 称取3g乙酰苯胺,放入250ml烧杯中,加入80ml水,加热至沸腾,若还未溶解可适量加入热水,搅拌,加热至沸腾。
2、 稍冷后,加入适量(0.5-1g)活性炭于溶液中,煮沸5-10min,趁热抽滤。
3、 将滤液放入冰水中结晶,将所得结晶压平。再次抽滤,称量结晶质量m。
五、试验数据
六、问答题
1、在布氏漏斗上用溶剂洗涤滤饼时应注意什么?
2、抽滤的优点有哪些?
3、使用布氏漏斗过滤时,如果滤纸大于漏斗瓷孔面时,有什么不好?
实验三 乙酰水杨酸的制备
一、实验目的
1、学习利用酚类的酰化反应制备乙酰水杨酸(acetyl salicylic acid)的原理和制备方法。
2、掌握重结晶、减压过滤、洗涤、干燥、熔点测定等基本实验操作。
二、实验原理
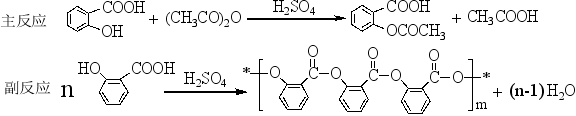
乙酰水杨酸即阿司匹林,可通过水杨酸与乙酸酐反应制得。
三、实验仪器和药品
圆底烧瓶、水浴锅、抽滤瓶、循环水真空泵、锥形瓶、玻棒、烧瓶、量筒、胶头滴管、天平、磁力加热搅拌器、温度计、滤纸、水杨酸、乙酸酐、浓硫酸、碎冰、饱和碳酸钠溶液、浓盐酸
四、实验步骤
1、在125ml的锥形瓶中加入2g水杨酸、5ml乙酸酐、5滴浓硫酸,小心旋转锥形瓶使水杨酸全部溶解后,在水浴中加热5-10min,控制水浴温度在85-90℃。取出锥形瓶,边摇边滴加1mL冷水,然后快速加入50mL冷水,立即进入冰浴冷却。若无晶体或出现油状物,可用玻棒摩擦内壁(注意必须在冰水浴中进行)。待晶体完全析出后用布氏漏斗抽滤,用少量冰水分二次洗涤锥形瓶后,再洗涤晶体,抽干。
2、将粗产品转移到150ml烧杯中,在搅拌下慢慢加入25mL饱和碳酸钠溶液,加完后继续搅拌几分钟,直到无二氧化碳气体产生为止。抽滤,副产物聚合物被滤出,用5-10ml水冲洗漏斗,合并滤液,倒入预先盛有4-5ml浓盐酸和10ml水配成溶液的烧杯中,搅拌均匀,即有乙酰水杨酸沉淀析出。用冰水冷却,使沉淀完全。减压过滤,用冷水洗涤2次,抽干水分。将晶体置于表面皿上,蒸汽浴干燥,得乙酰水杨酸产品。称重。
五、实验数据处理
六、思考题
1、本实验为什么不能在回流下长时间反应?
2、反应后加水的目的是什么?
3、第一步的结晶的粗产品中可能含有哪些杂质?
实验四 肥皂的制备
一、实验目的
1.了解皂化反应原理及肥皂的制备方法;
2.熟悉盐析原理,熟练掌握沉淀的洗涤及减压过滤操作技术。(盐析:向溶液中加入无机盐类使某种物质溶解度降低而析出的过程)
二、实验原理
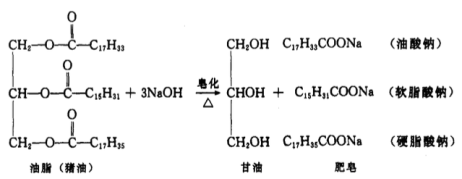
动物脂肪的主要成分是高级脂肪酸甘油酯。将其与氢氧化钠溶液共热,就会发生碱性水解(皂化反应),生产高级脂肪酸钠(肥皂)和甘油。在反应混合液中加入溶解度较大的无机盐,以降低水对有机盐的(肥皂)的溶解作用,可使肥皂较为完全的从溶液中析出,这一过程叫做盐析。利用盐析原理,可将肥皂和甘油较好的分离。
本实验以熟猪油为原料制取肥皂,反应式如下:
三、实验药品及仪器
1.试剂:
熟猪油5g;;饱和食盐水150mL;95%乙醇15mL。
2.仪器:
烧杯;酒精灯;石棉网;三脚架;布氏漏斗;抽滤瓶;天枰;量筒。
四、实验步骤
1.皂化:在250mL烧杯中加入5g熟猪油、15mL95%乙醇和15mL 40%氢氧化钠溶液,搅拌使其溶解(期间若溶解困难可微热),待溶解完后将烧杯置于石棉网上用酒精灯缓慢加热(温度不能太高),并不断用玻璃棒搅拌,加热约20min,直到混合液变稠,皂化反应基本完全(若需检验,可用玻璃棒取出几滴试样放入空烧杯中,在其中加入蒸馏水5~6ml,加热振荡。静置时有油脂分出,说明皂化不完全,可滴加碱液继续皂化)。
2.盐析分离:皂化反应结束后,将20ml热的蒸馏水慢慢加到皂化完全的粘稠液中,搅拌使它们互溶。然后趁热将该粘稠液慢慢倒入盛有150ml饱和食盐溶液的烧杯中,边加边搅拌,静置冷却。将充分冷却的皂化液倒入布氏漏斗中,减压过滤,用冷水洗涤滤饼两次(直接将冷水倒入漏斗中的滤饼上面即可),抽干。
五、实验数据:
六、思考题:盐析的原理是什么?
实验五 乙酰苯胺的制备
一、实验目的:
1.掌握苯胺乙酰化反应的原理和实验操作;
2.掌握固体有机物提纯的方法---纯结晶。
二、实验原理:
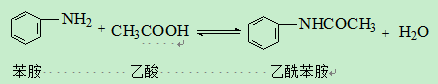
本实验采用冰醋酸作为酰化剂,与苯胺反应制备乙酰苯胺。酰化产物比芳胺稳定,且水解后可生成原来的胺,因此该反应在有机合成中可用于保护氨基。化学反应式如下:
三、实验药品及仪器:
1.试剂:苯胺5 mL、冰乙酸15mL、0.1g锌粉、1g活性炭
2.仪器:电热套、直型冷凝管、蒸馏头、尾接管、温度计(200℃)、圆底烧瓶(250mL)、烧杯(250mL)、量筒(10mL)、布氏漏斗
四、实验步骤
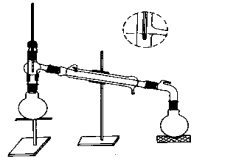
1.分馏:在250mL圆底烧瓶中,加入5 mL苯胺、15mL冰醋酸和0.1g锌粉。立即安装蒸馏装置,用小量筒收集蒸出的水和乙酸。用电热套缓慢加热至微沸,温度计读数为90度,维持温度约30min,这时反应所生成的水基本蒸出。当温度计的读数不断下降时,则反应达到终点,即可停止加热。(实验装置图如下图所示)
2.产品分离:在烧杯中加入100ml冷水,将上述反应液趁热以细流倒入水中,边倒边搅拌,此时有细粒状固体析出。冷却后抽滤,并用少量冷水洗涤固体滤饼(用冷蒸馏水冲洗滤饼),得到白色或带黄色的乙酰苯胺粗品。
3.重结晶:将粗产品转移到500ml烧杯中,加入100ml水,在搅拌下加热(用酒精灯加热)至沸腾。观察是否有未溶解的油状物,如有则补加水,直到油珠全溶。稍冷后,加入1g活性炭(活性炭不能加入沸腾溶液中,以免溶液暴沸),搅拌并煮沸5min。然后趁热用布氏漏斗过滤(可用热水冲洗滤饼),将滤液冷却至室温,乙酰苯胺析出,抽滤,即得无色片状的乙酰苯胺晶体。干燥,称量并计算产率。
五、思考题:反应瓶中的白雾是什么?